美国学者 Mary E. Brunkow、Fred Ramsdell 和日本学者 Shimon Sakaguchi,因为成功鉴定出了调节性 T 细胞,获此殊荣。

诺贝尔奖官网公布了一份三位科学家获奖的科学背景,详细描述了他们发现并逐步验证 Treg 细胞的全过程。
丁香园对其进行了完整编译,以供同行学习参考:
“
免疫系统是一个精妙复杂的平衡体系:既能对抗感染,提供强大防御,又在大多数情况下避免对自身组织发动破坏性攻击。这种平衡如何维持? 这一问题困扰了免疫学界一个多世纪。
通过敏锐的观察与精心设计的实验,本年度诺贝尔生理学或医学奖得主 Mary E. Brunkow、Fred Ramsdell 和 Shimon Sakaguchi 给出了关键答案。
他们揭示了 CD4⁺、CD25⁺、FOXP3⁺ 调节性 T 细胞(Treg 细胞) 的存在及其在抑制自身反应中的重要性,由此奠定了 Treg 细胞介导的外周免疫耐受 这一研究领域。
这段科学历程充满了好奇心驱动的探索、持之以恒的研究和关键性的发现,彻底革新了人们对免疫调控的理解,并对 自身耐受、自身免疫病及肿瘤免疫逃逸 等问题具有深远意义。
健全的免疫系统对人类的生存和健康至关重要。没有它,我们在充满各种微生物的环境中将极度脆弱。感染发生时,先天免疫系统会率先做出反应,而适应性免疫系统则需要数天才能被动员。适应性免疫系统的一大特点是具备「记忆」功能:当再次遭遇相同病原体时,它能更快、更高效地发动应答。
这种免疫记忆依赖于 T 细胞和 B 细胞,它们能够识别外来结构(抗原)。识别过程由抗原受体介导,分别是 T 细胞受体(TCR) 和 B 细胞受体(BCR,或膜结合抗体)。这些受体在淋巴细胞发育过程中产生,每个淋巴细胞都拥有独一无二的抗原受体。
正因如此,免疫系统具备了几乎无限的能力去识别一生中可能遇到的各种外来结构。
抗原识别是如何实现的?
在 20 世纪 80 年代之前,科学界一直困惑:我们体内为什么能产生如此庞大的抗原受体库?显然,基因组空间远远不足以支持「一基因一受体」的假说。
突破来自 Susumu Tonegawa。他发现,在 B 细胞发育过程中,大量种子基因片段——可变区(V)、多样性区(D)和连接区(J)基因——通过重组与组合 的方式拼接在一起,最终形成独一无二的重链(VDJ)和轻链(VJ),构成每个 B 细胞的功能性受体。这一系列成果让他获得了 1987 年诺贝尔生理学或医学奖。
随后,多伦多大学的 Tak Mak 与 斯坦福大学的 Mark Davis 团队发现,T 细胞受体(TCR)同样由 V、D、J 基因片段重组形成,每个人体内理论上可生成 10^15 种不同的 TCR。TCR 主要由 α 链与 β 链(αβ T 细胞)或 γ 链与 δ 链(γδ T 细胞)组成,其中大多数 T 细胞属于 αβ 型,包括本年度诺奖核心的调节性 T 细胞(Treg)。
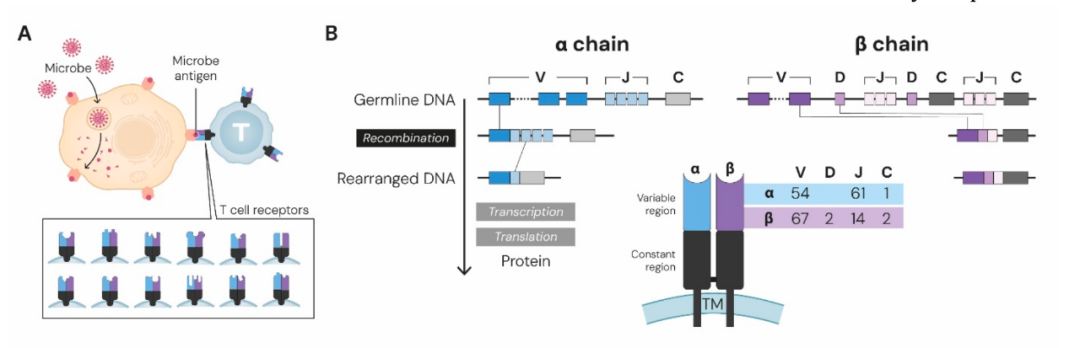
研究还显示,αβ T 细胞可细分为功能互补的两大类:
CD4⁺ T 辅助细胞:协调并支持细胞免疫和体液免疫。
CD8⁺ 细胞毒性 T 细胞:直接识别并清除感染细胞或肿瘤细胞。
这两类 T 细胞都依赖 主要组织相容性复合体(MHC)分子 递呈抗原。MHC 基因最早在 20 世纪 40~50 年代由 George Snell 在小鼠中发现,随后 Jean Dausset 描述了人类对应的 HLA 基因,三人共同因该发现获得 1980 年诺贝尔生理学或医学奖。
这段科学探索,串联起了 受体重组、抗原呈递与免疫识别 三大核心机制,奠定了现代免疫学的基石。
MHC 分子最初因其在器官移植后诱发排斥反应而被发现,但它们真正的生理功能长期不明。20 世纪 70 年代,Peter Doherty 与 Rolf Zinkernagel 的研究提供了突破性证据:T 细胞只有在 MHC 分子的背景下才会对病毒作出反应,这一现象被称为 MHC 限制性(MHC restriction)。他们因此在 1996 年获得诺贝尔生理学或医学奖。
进一步的实验揭示了 MHC 的功能分工:
CD8⁺ 细胞毒性 T 细胞识别由 MHC I 类分子 呈递的病毒或肿瘤来源的肽段;
CD4⁺ 辅助性 T 细胞则识别由 MHC II 类分子 呈递的抗原肽。
这一机制的确立得益于多位科学家的工作:
Alain Townsend 证实 CD8⁺ T 细胞依赖 MHC I 识别抗原(1985~1986);
Emil R. Unanue 证实 CD4⁺ T 细胞识别 MHC II 呈递的肽段(1985);
Pamela Bjorkman 与 Don Wiley 则通过结构生物学研究阐明了 MHC 分子与抗原肽的结合方式(1987)。
至此,MHC 不仅被视为「排斥移植的元凶」,更成为免疫应答特异性与自我/非我识别的核心枢纽。
尽管 BCR 与 TCR 的高度多样性极大提升了免疫系统识别外来抗原的能力,但这也带来一个代价:部分受体会意外识别自身抗原。早在 1908 年,诺贝尔奖得主 Paul Ehrlich 就将这一现象形象地称为「自体中毒恐惧(horror autotoxicus)」。
事实证明,揭示严重自身免疫表现背后的分子机制是免疫学的一大挑战。然而,自 Ehrlich 及其同时代研究者的工作起,临床医生与科学家们就已意识到:强大的免疫系统伴随潜在风险。为了深入理解免疫介导疾病,并推动相应治疗的研发,阐明免疫调控的细胞与分子机制显得至关重要。
免疫耐受是如何实现的?
那么,免疫耐受究竟是如何建立和维持的呢?
最早针对这一问题的实验证据来自 Ray Owen。1945 年,他在 Science 发表研究:不同血型的小牛在胎盘循环中共享血液后形成嵌合体,出生后它们竟然不会对彼此的血型抗原产生免疫反应,这一意外发现提供了重要线索。
几乎同时,Frank Macfarlane Burnet 提出假说:如果在胚胎期植入外源细胞并成功存活,动物出生后就不会对这些「外来抗原」产生免疫应答。他因此预测,免疫耐受应在胚胎或早期生命阶段获得。
1953 年,Peter Medawar 与同事在伦敦大学学院进行经典实验:将一品系小鼠胎儿注入另一品系的细胞,结果出生后的受体小鼠能接受第二品系的皮肤移植物,却排斥第三品系的移植物。他们提出这一机制是「主动获得性耐受」。同年,捷克科学家 Milan Hašek 也通过「并体术」连接鸡胚胎血管系统,得出类似结论,只因发表在俄文地方期刊而长期被忽视。
此后,Burnet 在 1957 年提出 克隆选择学说,强调选择发生在细胞水平而非抗体水平。他进一步扩展为正向选择理论,并在 1960 年与 Medawar 共同因「获得性免疫耐受的发现」荣获诺贝尔生理学或医学奖。Burnet 之后又补充了 负向选择机制,即清除免疫库中错误识别自体的 T 细胞,从而完善了免疫耐受理论。
这些奠基性工作,使「免疫系统如何学会区分自我与非我」这一百年谜题逐渐解开。
在很长一段时间里,胸腺的功能(也即 T 细胞的存在)一直不为人所知。直到 1961 年,Jacques Miller 在伦敦 Chester Beatty 研究所工作时发现,新生小鼠切除胸腺后会出现严重免疫缺陷,并缺乏特定的淋巴细胞亚群。
二十多年后,Philippa Marrack 与 John Kappler(美国丹佛 National Jewish Center)以及 Harald von Boehmer 团队(瑞士巴塞尔免疫研究所)提供了决定性证据:自反应性 T 细胞会在胸腺中通过「负向选择」被清除。
研究随后聚焦于「中枢耐受(central tolerance)」的分子机制。1997 年,两支独立团队发现了 AIRE(autoimmune regulator)基因:
一支由 Leena Peltonen 领导的芬德联合团队,基于芬兰儿科医生 Jaakko Perheentupa 收集的大量 APS-1(自身免疫性多内分泌综合征 1 型)患者样本。
另一支由 Nobuyoshi Shimizu 领导的日本团队。
2002 年,Mark Anderson、Christophe Benoist 与 Diane Mathis 揭示了 AIRE 的作用机制:作为转录因子,AIRE 可在胸腺髓质上皮细胞(mTECs)中启动外周组织特异性抗原的表达,从而让新生 T 细胞在胸腺内接受「自体耐受测试」。
若未表现出显著自反应性,T 细胞得以存活并进入外周循环。
若对自身抗原高度反应,则通过凋亡被清除。
这种清除潜在有害自反应 T 细胞的机制被称为 中枢耐受,是适应性免疫系统的基石之一。
然而,AIRE 介导的负向选择并非绝对,一部分自反应 T 细胞仍能「逃逸」胸腺清除并进入外周。这促使研究者推测:必然存在额外机制来约束这些细胞。
一个关键问题是,是否存在一个专门的抑制性 T 细胞亚群? ——这一谜题的答案,正是本年度诺贝尔奖的核心发现。
外周免疫耐受机制
除了胸腺中的中枢耐受,免疫系统在外周也进化出了多重「安全阀」来避免自身反应。
共刺激(co-stimulation)模型 是其中的核心。20 世纪 80 年代,Mark Jenkins 和 Ron Schwartz(NIH)发现,如果 T 细胞受体(TCR)与抗原结合,但缺乏额外的共刺激信号,T 细胞会进入「无反应」(anergy)状态。
随后研究者鉴定了 CD28 分子,它与抗原呈递细胞上的 CD80/CD86 结合,传递正向共刺激信号。而 CTLA4 则是负向共刺激分子,阻断 CD28 信号。James Allison 发现抗 CTLA4 抗体可重新激活 T 细胞攻击肿瘤,由此获得 2018 年诺贝尔奖。
树突状细胞(DCs) 是另一条重要途径。2011 年诺奖得主 Ralph Steinman 发现,当抗原在无共刺激条件下由 DC 呈递时,会诱导 T 细胞耐受,这类 DC 被称为「耐受性 DCs」。
B 细胞介导的耐受 也得到证实。Christopher Goodnow 与 Antony Basten 利用转基因小鼠证明了 B 细胞克隆无反应(clonal anergy) 的存在。此外,还发现一类 调节性 B 细胞(Bregs) 能分泌 IL-10 抑制免疫反应。
这些研究共同表明,外周免疫耐受通过多重机制协同维持,其中最关键的机制是 调节性 T 细胞(Tregs),也是本年度诺贝尔奖的核心主题。
「抑制性 T 细胞」概念的曲折历程
早在 1970 年代,研究者提出了「抑制性 T 细胞(suppressor T cells)」 的概念,认为某些 T 细胞群体可以抑制免疫反应。然而,该领域的方法学不一致、缺乏特异性标志物,且无法清晰区分这些细胞与其他 T 细胞亚群。
当时普遍认为这类细胞属于 CD8⁺ T 细胞,并且小鼠 I-J 基因座 编码了关键调控分子。但随着基因测序技术进步,人们发现 I-J 基因座并不存在,学界热情迅速消退,最终这一研究方向几乎被放弃。
尽管如此,早期部分实验结果可能并非错误,只是缺乏确凿证据支撑。直到后来 调节性 T 细胞(Tregs) 的发现与分子机制阐明,才真正让这一研究领域得以复兴。
调节性 T 细胞的「复兴」
免疫调控的研究在 1980~1990 年代重新获得动力,其中 Shimon Sakaguchi 及其日本同事发挥了关键作用。
早在 1969 年,Yasuaki Nishizuka 与 Teruyo Sakakura 就发现:若在小鼠出生第 3 天切除胸腺,会自发出现卵巢发育不良,这是由自身免疫性卵巢功能衰竭引起的,并伴随多种自身免疫疾病,包括胃炎和甲状腺炎。
1973 年,William J. Penhale 将这一观察拓展到大鼠,他发现新生大鼠胸腺切除会诱发自身免疫性甲状腺炎,并伴随甲状腺自身抗体的出现。更重要的是,若向这些无胸腺大鼠输入健康动物的淋巴细胞,可防止甲状腺炎发生。
在完成京都大学医学学习后,Sakaguchi 加入了 Nishizuka 的实验室。1982 年,他们在小鼠实验中证实:将正常小鼠中特定免疫细胞群转移到胸腺切除小鼠体内,可以阻断其自身免疫反应。
这一群细胞的特征是 表达表面标志 CD5(Lyt-1)并具有低水平的 CD45RB。当时尚无针对特定细胞表面分子的单克隆抗体,研究只能依靠异体血清来分类细胞,工具有限,但局面很快得到改善。
随着单克隆抗体技术的应用,研究进入新阶段。Fiona Powrie 与 Don Mason(牛津大学)发现:当高水平 CD45RB 的 CD4⁺ T 辅助细胞被注射入无胸腺小鼠时,会导致严重的消耗性疾病,表现为肝、肺、胃、甲状腺和胰腺的炎症浸润;而注射 低水平 CD45RB 的 CD4⁺ T 细胞则能保护动物免于发病。他们据此提出:外周 CD4⁺ T 细胞群体中存在功能异质性与专门化,这正是免疫调控机制的体现。
这些研究逐步铺平了道路,为后续确认调节性 T 细胞(Tregs)的关键身份与分子机制奠定了基础。
第一次重大突破 —— 确定关键 T 细胞亚群
为进一步揭示免疫调控机制,Shimon Sakaguchi 在早期研究中已经注意到 CD5⁺/CD45RB^low T 细胞具有免疫抑制功能。此后,他尝试利用更多表面标志物对这一群体进行更精细的分离。
1995 年,Sakaguchi 团队发表了里程碑式的成果:他们发现 表达 CD25(IL-2 受体 α 链)的 CD4⁺ T 淋巴细胞具备免疫调控功能。
实验设计显示:
当将来自 Balb/c nu/+ 杂合鼠的脾脏和淋巴结中 去除 CD25⁺ T 细胞的 CD4⁺ T 细胞群转入 Balb/c 无胸腺裸鼠后,这些小鼠很快出现了典型的自身免疫疾病,包括 甲状腺炎、胃炎、胰岛炎、肾上腺炎及多关节炎(组织学和血清学均可证实)。
然而,如果在转移 CD4⁺CD25⁻ T 细胞后的有限时间内,再补充 CD4⁺CD25⁺ T 细胞,则可以完全阻止这些自身免疫病的发生。
这一发现首次明确:CD4⁺CD25⁺ T 细胞是维持机体免疫自我耐受的关键亚群。它们后来被命名为调节性 T 细胞(Tregs),成为现代免疫学的重要里程碑。
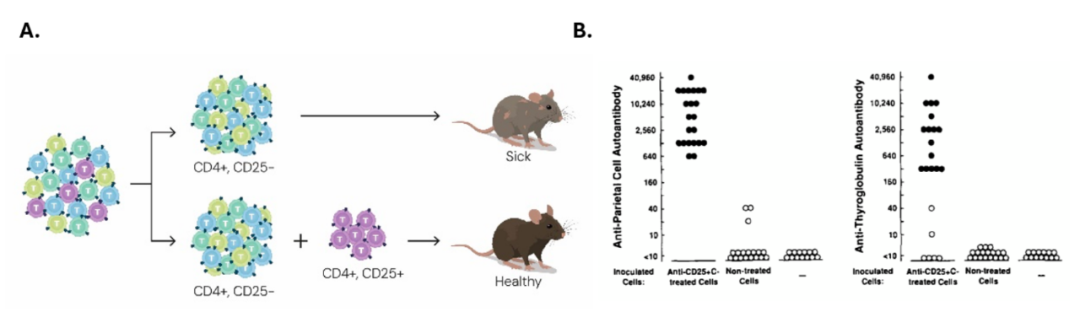
这一发现,为抑制免疫反应的调节性 CD4⁺CD25⁺ T 细胞亚群的存在提供了有力证据。很快,这一发现也得到了位于美国贝塞斯达国立卫生研究院的 Ethan Shevach 实验室及其他研究团队结果的支持。
CD4⁺CD25⁺ T 细胞的鉴定标志着免疫学领域的一项突破,并为后续的深入研究奠定了基础。「调节性 T 细胞」这一术语,在 20 世纪 70~80 年代曾被偶尔使用,然而,直到 Sakaguchi 将 CD4⁺CD25⁺ 亚群定义为调节性 T 细胞后,「Treg 细胞」这一术语才在科学界获得广泛接受。
Sakaguchi 及其同事证明,大多数调节性 T 细胞起源于胸腺。他们还与 Powrie 研究组同时(通过背靠背发表的文章)鉴定出了这些细胞的另一个标志物:CTLA-4。
在移植生物学的并行研究中,来自澳大利亚悉尼的 Bruce Hall 和 Susan Dorsch,在环孢素 A 处理的同种异体心脏移植小鼠受体中,描述了一个具有抑制功能的淋巴细胞亚群。他们将其称为 CD4⁺ T 细胞,随后他们发现,这些细胞同时表达 CD25。
当时,移植生物学和免疫耐受领域重叠甚少,两个领域的研究人员并未频繁交流信息或整合他们的结果。
Hall 和 Dorsch 并未研究他们鉴定的细胞在正常生理条件下(未经环孢素 A 治疗时)是否在自身耐受中发挥作用。因此,仍缺乏更广泛意义上解释免疫耐受的决定性证据。
随着技术的发展和免疫调节兴趣的增加,研究人员试图更好地理解由 Sakaguchi 鉴定的细胞的起源、机制和界定特征。虽然 CD25 被证明是一个有用的标志物,但它也在活化的传统效应 T 细胞上表达(水平较低),这限制了其作为识别调节性 T 细胞亚群的特异性。
实验研究表明,这些细胞可通过多种机制抑制传统 T 细胞的增殖和细胞因子产生:细胞间接触依赖性相互作用、分泌抑制性细胞因子(如 IL-10、IL-35 和 TGFβ)以及隔离 IL-2,从而剥夺其他 T 细胞所必需的一种关键生长因子。
尽管 CD4⁺CD25⁺ T 细胞维持耐受和预防自身免疫的能力已知,但怀疑论依然存在,且仍缺乏一个决定性的分子标志物,阻碍了该领域的进展。随着一个选择性控制调节性 T 细胞亚群发育和功能的机制的发现,这一情况将发生巨大改变。
第二次突破:scurfy 小鼠与 FOXP3 的发现
20 世纪 40 年代,在美国田纳西州能源部橡树岭国家实验室,作为曼哈顿计划的一部分,研究人员研究了辐射对小鼠的影响。实验室人员注意到一个自发性突变体,并将其命名为 scurfy。
这一品系小鼠发生严重的自身免疫病,育种研究显示该突变在雄性小鼠中是致死性的,而雌性小鼠不受影响。因此,结论是导致自身免疫表型的突变位于 X 染色体上。
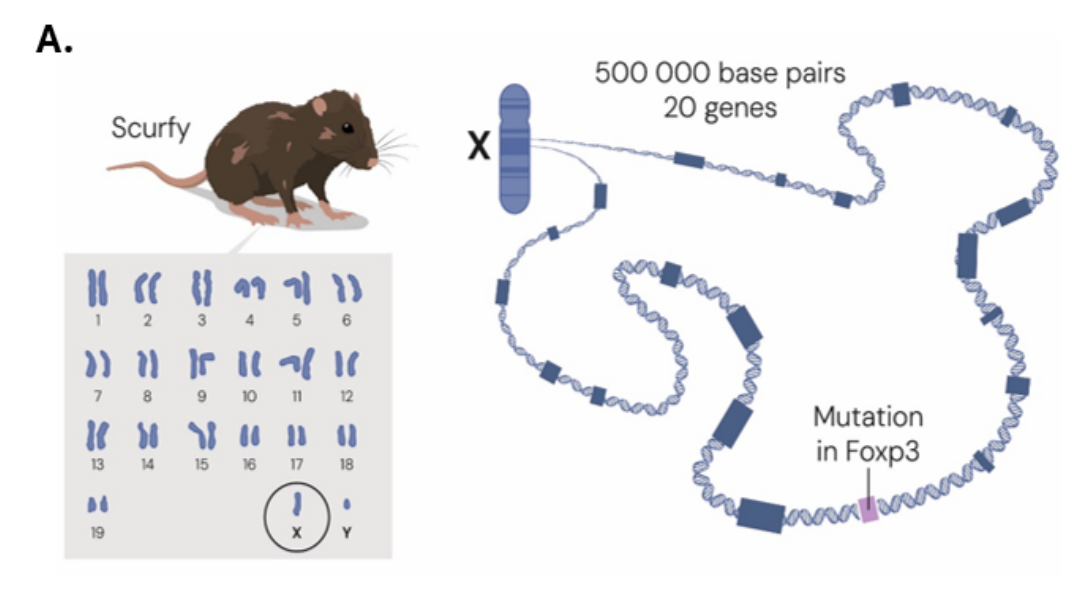
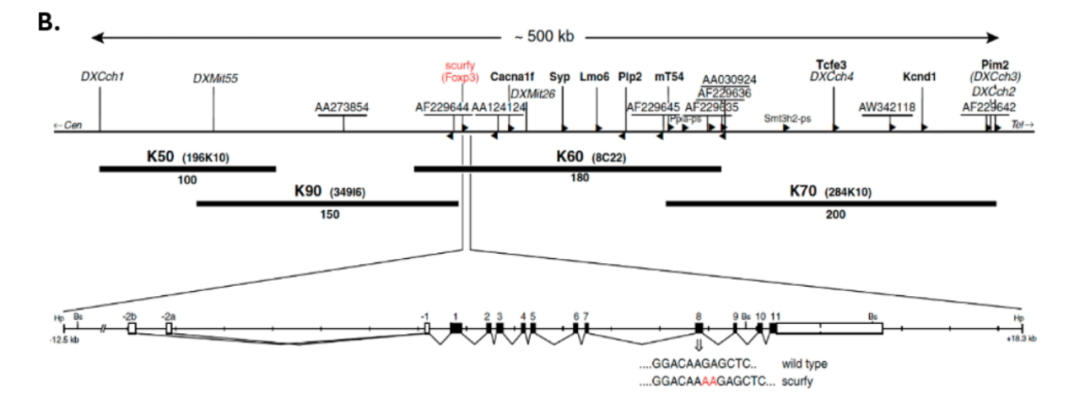
scurfy 小鼠严重的多系统自身免疫表型引起了在美国华盛顿州博塞尔 Celltech Chiroscience Inc. 公司的 Mary Brunkow 和 Fred Ramsdell 的注意。在一个雄心勃勃、由好奇心驱动的项目中,他们着手利用当时可用的定位克隆技术来鉴定 scurfy 突变。
经过努力,他们将 X 染色体上的候选区域缩小至 50 万个碱基。从这个区段中,他们分离出 11 个大的 DNA 片段作为细菌人工染色体克隆,并将注意力集中在其中的 4 个上。随机鸟枪法测序显示这些区域包含约 20 个基因。他们逐个对这些基因进行测序,并将其与人类和其他七个小鼠品系中的对应基因进行比较。
仅在检查最后一个基因时,Brunkow 和 Ramsdell 才鉴定出一个导致移码和提前终止密码子的两碱基对插入。这一基因先前未被描述,且在当时可用的数据库中不存在。由于它与其他叉头/翼状螺旋结构域基因具有同源性,Brunkow 和 Ramsdell 将基因命名为 Forkhead box P3(Foxp3)。

Brunkow 和 Ramsdell 并未止步于此。为了正式证明该突变是导致 scurfy 表型的原因,他们进行了一系列基因拯救实验。他们构建了五个携带 Foxp3 基因的转基因小鼠系,每个系具有不同的拷贝数,并分别将它们与 scurfy 小鼠杂交。通过这些严谨而确凿的实验,团队证明了野生型 Foxp3 能够拯救雄性 scurfy 小鼠免于疾病。
在发现之后,Brunkow 和 Ramsdell 立即将注意力转向一种罕见的遗传性人类疾病,即 IPEX(免疫失调、多内分泌腺病、肠病、X 连锁)综合征或 XLAAD(X 连锁自身免疫-过敏失调)综合征。这种疾病的特征是在男童中发生致命的自身免疫病,除非他们接受异基因干细胞移植。
2001 年,通过与位于美国西雅图华盛顿大学儿科的 Hans Ochs 和美国俄勒冈州波特兰市俄勒冈健康科学大学的 Robert Wildin 及其团队的合作,Brunkow 和 Ramsdell 证明了 FOXP3(人类中对应于 scurfy 小鼠突变基因的基因)的突变是导致 IPEX 的原因。
由美国圣路易斯华盛顿大学医学院的 Chatila 及其同事领导的一个团队也研究了 IPEX/XLAAD 患者。他们专注于两个转录因子,Tcfe3 和 JM2,后者是 FOXP3 的别称。对这些基因外显子的序列分析结果发现,在患病患者中,JM2 基因的第 10 号外显子内插入了一个小内含子。
Chatila 等人的发现提供了重要的见解,但并未构成 FOXP3 突变在免疫失调中起致病作用的正式实验证据。如上所述,这一证据由 Brunkow 和 Ramsdell 利用 scurfy 小鼠品系确立,这凸显了将实验动物模型与临床研究相结合的价值。
建立联系与界定 Treg 谱系
分离出具有 CD4⁺CD25⁺ 细胞表面特征的调节性T细胞亚群、鉴定出 Foxp3,继这两项关键发现之后,Sakaguchi 的团队迅速建立了联系,证明 Foxp3 选择性表达于 CD4⁺CD25⁺ T 淋巴细胞,并且 Foxp3 的逆转录病毒转染可将传统 CD4⁺ T 细胞转化为 Treg 细胞。
此后不久,Ramsdell 研究组独立地证明,scurfy 小鼠中缺乏 Treg 细胞,并且过表达 Foxp3 的小鼠表现出 Treg 细胞数量增加。同时,霍华德休斯医学研究所和华盛顿大学的 Alexander Rudensky 构建了 Foxp3 缺陷小鼠。
在与 Ramsdell 研究同时发表的一篇论文中,Rudensky 团队报告 Foxp3 缺陷小鼠表现出与 scurfy 品系惊人相似的表型。Rudensky 研究组随后表明,仅在 T 细胞区室中缺失 Foxp3 就足以诱导早发性淋巴增殖综合征和自身免疫,类似于在 Foxp3 缺陷小鼠中发现的情况。
总而言之,今年诺贝尔奖获得者取得的关键发现已明确表明,缺少一种由单一基因位点 foxp3/FOXP3 控制的细胞类型——Treg 细胞,就足以打破耐受并在小鼠和人类中引起「自身恐怖」。这一开创性的发现揭示了一种维持机体稳态的基本机制,并为这个高度活跃且不断扩展的研究领域奠定了基础。
根据上述简短的科学发展史,我们应如何定位 Treg 细胞在免疫耐受理解中的地位?它们无疑是获得诺贝尔奖的「获得性耐受」概念的一部分,并且在某种程度上也是中枢(胸腺)耐受(这一主流教条已盛行 50 多年)的一部分。
然而,Treg 细胞在概念上脱颖而出,因为它们在中枢(胸腺阳性选择期间)获得其致耐受能力,但在外周组织中执行其功能;并且它们可以通过控制其他免疫细胞在整个生命周期中发挥作用。
最重要的是,这些发现为 Treg 细胞提供了一个分子「抓手」,将外周免疫调节领域推动至今天这个高度活跃的研究状态。现在可以详细表征 Treg 细胞,并探索不同的策略来利用或抑制其活性以治疗一系列疾病。
Treg 细胞的特征与细微差别
作为一种转录因子,Foxp3 协调调控大量基因的表达,这些基因决定了 Treg 细胞的发育和功能特性,包括其抑制能力。
如 scurfy 小鼠品系和临床 IPEX 综合征中所观察到的,缺乏功能性 Foxp3/FOXP3 基因的小鼠和人类会发生致命的多器官自身免疫病,这强调了Treg细胞在免疫调节中的基本作用。
随着 Foxp3 的鉴定,研究人员能够利用流式细胞术和遗传工具来精确识别和研究 Treg 细胞。这促进了其他 Treg 细胞亚群的识别,例如在外周组织中特定情况下发育的外周诱导的 Treg 细胞(pTregs)。
也可以在体外通过提供适当的细胞因子刺激(通常是高剂量 IL-2 和 TGFβ)从传统 CD4⁺ T 细胞生成所谓的诱导性 Treg 细胞(iTregs);然而,iTregs 的 FOXP3 表达通常不如胸腺来源的 Treg 细胞(tTregs)稳定。
随着该领域的成熟,研究表明人类 Treg 细胞比小鼠 Treg 细胞表现出更复杂性。例如,在活化的人类传统 CD4⁺ T 细胞中可以检测到低水平的 FOXP3。
Treg 细胞如何在胸腺中被选择,包括是否存在一个亲和力阈值来决定 T 细胞是被克隆删除还是被选入 Treg 细胞库,或者亲合力或其他背景因素是否影响结果,仍然是备受关注的话题。
前沿的 Treg 研究
具有不同特性的 Treg 细胞群已被证明起源于不同的发育途径,这是一个值得进一步研究的问题。Treg 细胞在不同疾病背景下的行为也是一个正在被深入研究的问题。
例如,Treg 细胞已在持续的自身炎症性疾病背景下被研究,结果表明,存在于炎症环境中的 Treg 细胞比此类环境外的 Treg 细胞更依赖 Foxp3 来维持其功能。
研究也致力于描绘控制 Treg 细胞分化的调控网络。在 FOXP3 表达上游或同时发生的转录事件被证明影响人类 Treg 细胞的发育。Sakaguchi 团队还鉴定出控制 FOXP3 表达的非编码遗传元件,影响 Treg 细胞的发育和维持。为了改进当前用于临床的体外生产 iTreg 细胞的方案,Sakaguchi 已描绘出负向调节 FOXP3 表达的阻遏复合物,这些复合物可作为靶点以改进 iTreg 的生产。
总体而言,Treg 细胞的影响范围广泛,从维持自身耐受和预防自身免疫,到避免妊娠期间胎儿排斥、控制慢性炎症,以及在感染性疾病中调节免疫反应以防止造成伤害多于保护的过度活动。
靶向 Treg 细胞的临床方法
Treg 细胞的治疗潜力在很大程度上尚未被开发。虽然 Treg 细胞疗法尚未进入临床,但众多调节其活性的策略正在研究中,其中一些已在临床试验中进行评估。
靶向 Treg 细胞对于治疗自身免疫性疾病和过敏,以及降低移植排斥风险具有重要的治疗潜力。相反,通过清除或失活肿瘤浸润性 Treg 细胞来增强抗肿瘤免疫的策略也正在进行中。界定对共生微生物产生免疫耐受的基础(其中 Treg 细胞和致耐受性抗原呈递细胞均发挥作用)的工作也在进展中,已有综述论述。
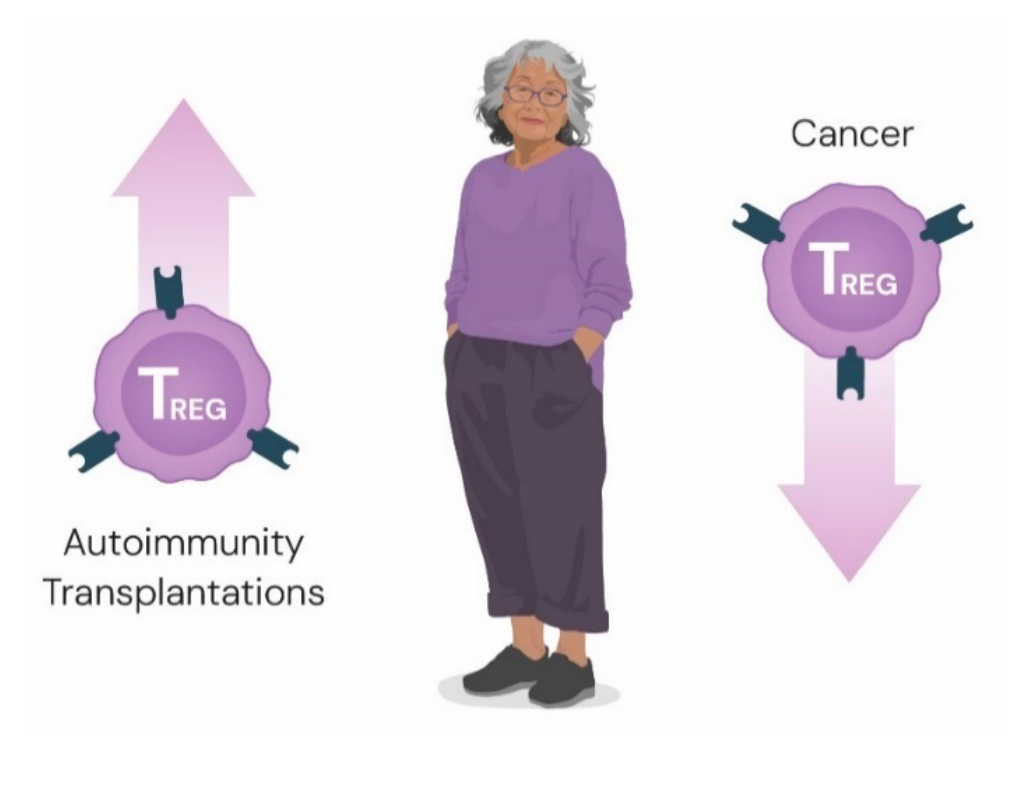
目前,有超过 200 项涉及调节性 T 细胞的临床试验,旨在治疗常见疾病如哮喘、炎症性肠病和皮肤相关疾病,或改善器官移植后的结局或治疗癌症。
在临床环境中利用 Treg 细胞潜力的方法包括:
体外扩增多克隆 Treg 细胞:例如,使用 IL-2 刺激,然后进行回输;
嵌合抗原受体调节性 T 细胞(CAR-Tregs):对 Treg 细胞进行工程化改造,使其表达一个由靶向抗体结构域组成的嵌合受体。CAR-Tregs 的目的是通过将调节活性靶向特定解剖部位来抑制炎症;
T 细胞受体 Treg(TCR-Tregs)细胞:对 Treg 细胞进行工程化改造,使其表达一个特定的 TCR,用于已知致病表位的疾病,例如乳糜泻;
体内扩增 Treg 细胞:使用低剂量 IL-2 或 IL-2 受体激动剂 Rezpegaldesleukin。后者已用于一项随机对照试验,证明对中重度特应性皮炎患者有效;
肿瘤浸润性 Treg 细胞上 CCR8 的鉴:促进了旨在靶向和清除肿瘤相关 Treg 细胞的单克隆抗体的开发,相关临床试验正在进行中。
尾声
今年诺贝尔奖获得者关于调节性 T 细胞和 FOXP3 的鉴定及其在免疫耐受中作用的历史,证明了科学毅力的力量以及将临床观察与基础研究相结合的重要性。
从早期的免疫耐受研究,到有争议的抑制性 T 细胞假说,再到通过 CD4⁺CD25⁺ 和 FOXP3 对 Treg 细胞进行的分子定义,最终形成了一个广阔的领域,揭示了免疫调节的基本原理。
随着我们对 Treg 细胞理解的加深,利用其力量进行治疗获益的潜力也在增加——保护我们免受自身免疫和免疫病理学的双重危害,同时确保免疫系统的稳态。
图片、内容来源:诺贝尔奖官网
策划:肯德羊、iroka|监制:z_popeye
